キヤノンマーケティングジャパングループのキヤノンITソリューションズ株式会社(本社:東京都品川区、代表取締役社長:神森晶久、以下キヤノンITS)は、副作用報告の新規格E2B(R3)に対応した製薬企業向けEDIシステム「EDI-Master DEX for Medical」新バージョンを2016年9月下旬より発売します。
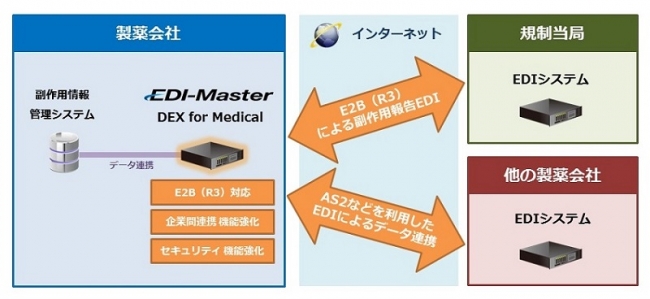
「EDI-Master DEX for Medical」は、製薬企業および規制当局(厚生労働省)の間で行われている医薬品等の副作用等の報告(以下副作用報告)を電子的に行うEDI(電子データ交換)システムです。今回のバージョンアップでは、ICH(日米EU医薬品規制調和国際会議)により規定され、国内では2016年4月より運用が開始された副作用報告のデータ交換規格E2B(R3)に対応した機能を実装しました。
国内の製薬企業は、医薬品の副作用によるものと疑われる症例等を確認した場合、厚生労働省に対し報告することが義務づけられており、従来E2B(R2)に基づいたデータ交換による報告を行ってきました。「EDI-Master DEX for Medical」は、これまで副作用報告の仕組みとして80社以上の製薬企業に導入、利用されており、信頼性や機能性において高い評価を獲得してきました。
2016年4月より国内で運用が開始された新規格E2B(R3)は、よりグローバル基準に対応し迅速なデータ交換を可能にするためにデータ項目の見直し等が行われた国際標準規格です。2019年3月まで設けられた並行運用期間中にE2B(R2)からE2B(R3)への移行を行うことが、PMDA(独立行政法人医薬品医療機器総合機構)より通知されています。
「EDI-Master DEX for Medical」新バージョンは、この新規格E2B(R3)へのスムーズな移行を実現します。国内においては、新たに利用が開始される通信プロトコル「AS2」を利用することで、規制当局に加え製薬企業同士で副作用情報を交換することでき、より迅速な情報活用が可能となります。また、副作用報告に加え、ほかの製薬企業や関係会社との間でEDI環境を構築することが可能です。
キヤノンITSは、今後規制当局とのデータ交換だけでなく「EDI-Master DEX for Medical」を中核とした製薬企業向けの統合的な情報管理・活用ソリューションを提供していきます。キヤノンITSは製薬企業を中心に2020年までに累計100社のシステム構築、システム導入を獲得し、「EDI-Master」を中核とするEDIソリューション関連事業では、2020年に年間売上高25億円を目指します。
<製薬企業向けEDIシステム「EDI-Master DEX for Medical」のシステム概要図>
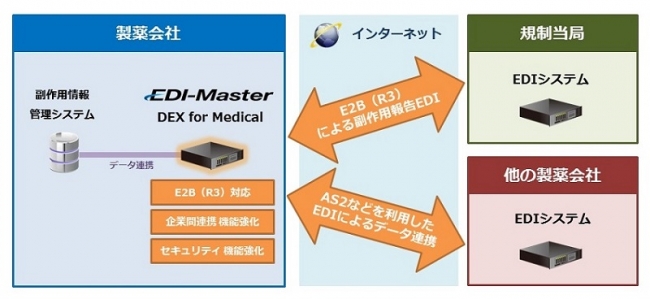
<製薬企業向けEDIシステム「EDI-Master DEX for Medical」新バージョンの特長>
新規格E2B(R3)に対応
・2016年4月より運用開始された、PMDA(独立行政法人医薬品医療機器総合機構)への新しい副作用情報報告形式ICH E2B(R3)への対応とそれに伴う操作性を向上させています。
企業間連携(B2B)機能を強化
・「取引先企業名による転送履歴情報の検索」「薬剤情報による送受信データの振り分け」「電子証明書管理」「データフォーマット変換」など、製薬企業間で副作用情報の交換をEDIで行い、業務効率化を実現する機能を強化しています。
セキュリティ機能強化
・IPA(独立行政法人情報処理推進機構)ガイドラインに基づくセキュリティレベル設定機能を追加しました。また、米国国家安全保障局 (NSA) Suite B暗号方式に対応しました。
企業プレスリリース詳細へ
PR TIMESトップへ